Transplantace inzulin produkující tkáně
Early vascular aging and how to influence it
MUDr. Peter Girman, Ph.D. Centrum diabetologie, Klinika diabetologie, Institut klinické a experimentální medicíny, Praha
SOUHRN Cílem inzulinové léčby diabetu je dosáhnout dlouhodobé normalizace glukózového metabolismu nebo se jí alespoň co nejvíce přiblížit. V současné době jsou transplantace pankreatu a nověji také transplantace izolovaných Langerhansových ostrůvků jedinými efektivními metodami, které dokáží u pacientů s diabetem 1. typu normalizovat nebo téměř normalizovat glykemie, a to bez rizika hypoglykemií a bez každodenního úsilí spojeného s monitorováním glykemií a podáváním inzulinu. Obě metody jsou ovšem limitované počtem vhodných dárců s mozkovou smrtí a obě vyžadují celoživotní imunosupresivní léčbu. U vhodně zvolených příjemců jsou dlouhodobé výsledky orgánové transplantace pankreatu velmi dobré. Za pět let od transplantace nepotřebuje inzulinovou léčbu až 80 % pacientů. Transplantace Langerhansových ostrůvků je sice pro pacienta jako zákrok jednodušší, ale procento pacientů, u kterých může být inzulinová léčba zcela přerušena, je zatím menší. Klíčová slova: transplantace pankreatu, transplantace izolovaných Langerhansových ostrůvků, diabetes mellitus SUMMARY
The aim of the diabetes treatment by intensified insulin regimen is to achieve long term normalization of glucose metabolism or at least to approach it as much as possible. Both pancreas and islet transplantation represent effective treatment modalities resulting in normoglyceamia in most of the recipients without a risk of severe hypoglycemia and everyday effort associated with glucose monitoring and insulin administration. The methods are limited by number of braindead donors and lifelong immunosuppressive treatment. Long term patient and graft survival rafter pancreas transplantation is excellent, resulting in more than 80% of recipient being free of exogenous insulin after 5 years. On the other hand, islet of Langerhans transplantation, as much safe and less invasive treatment, results in lower number of patients, in whom insulin treatment can be stopped.
Key words: pancreas transplantation, islet of Langerhans transplantation, diabetes mellitus
ÚVOD
Standardní léčbou pacientů s diabetes mellitus 1. typu je aplikace inzulinu ve vztahu k množství sacharidů obsažených v jídle tak, aby pacient dosahoval glykemie co nejbližší normálním hodnotám. Ani s pomocí dnes již sofistikovaných technologických postupů pro farmakologickou substituci inzulinu se však zatím nedaří zcela odstranit glykemickou variabilitu a zabránit tak progresi mikrovaskulárních komplikací či vzniku těžkých hypoglykemií.1
V současné době existují pouze dvě dostupné metody, které vedou k normoglykemii, a to transplantace slinivky břišní a transplantace Langerhansových ostrůvků. Principem obou způsobů je přenos orgánů nebo mikroorgánů (ostrůvků) z geneticky nepříbuzného dárce na příjemce. Technika orgánové transplantace je doménou chirurgických oborů a stále ještě přináší nezanedbatelná rizika. Postupy se od sebe mohou lišit typem žilní či arteriální anastomózy a způsobem drenáže pankreatického sekretu.
První transplantaci slinivky provedli 16. prosince 1966 William Kelly a Richard Lillehei v Minnesotě ve Spojených státech amerických. Od té doby do roku 2014 bylo podle mezinárodního registru transplantací pankreatu evidováno více než 48 000 výkonů z celého světa, z toho 28 000 v USA a přibližně 18 000 mimo Spojené státy.3 U nás bylo do konce roku 2018 evidováno více než 700 transplantací slinivky břišní, což Českou republiku řadí v tomto oboru s ohledem na počet obyvatel mezi nejaktivnější země. Ročně podstoupí v IKEM transplantaci 35–40 pacientů.
Podle dat z mezinárodního registru transplantací pankreatu bylo v období 2010–2014 naživu po šesti měsících od transplantace více než 98 % pacientů. V prvním a pátém roce po transplantaci je přežití pacientů 96 a 80 %. Hlavní příčinou úmrtí příjemců zůstávají kardiovaskulární komplikace, zahrnující i cerebrovaskulární příhody, které jsou odpovědné za třetinu všech úmrtí. Roční a tříleté přežití štěpů pankreatu je v kategorii SPK (simultánní transplantace pankreatu a ledviny, simultaneous pancreas and kidney transpalantation) 89 a 82 %. Přežití štěpů ledvin ve stejné kategorii je 95 a 88 %. Ve skupině PTA (izolovaná transplantace slinivky, pancreas transplant alone) přežívá po roce a po třech letech 84 a 75 % štěpů. Ve skupině PTA je zatím přežívání štěpů slinivek o něco horší než při kombinované transplantaci s ledvinou, ale tento rozdíl se postupně stírá. Po roce je funkčních přibližně 80 % štěpů, po třech letech 65 %.3
Nejčastějším důvodem selhání štěpu napříč kategoriemi jsou technické komplikace. Druhou nejčastější příčinou ve skupině SPK je úmrtí s funkčním štěpem. Výsledky transplantací pankreatu v České republice odpovídají výše uvedeným číslům. Nejlepší přežívání pacientů je ve skupině SPK.
Transplantace Langerhansových ostrůvků má za sebou dlouhou a náročnou experimentální historii, ale její klinická aplikace se začala dařit až po roce 2000. Z původně klinické experimentální metody se stal standardní léčebný postup, jehož výsledky jsou dnes hodnoceny v prospektivních randomizovaných studiích. Z historického pohledu se za hlavní změny, které vedly k úspěšným výsledkům považují:
SUMMARY
The aim of the diabetes treatment by intensified insulin regimen is to achieve long term normalization of glucose metabolism or at least to approach it as much as possible. Both pancreas and islet transplantation represent effective treatment modalities resulting in normoglyceamia in most of the recipients without a risk of severe hypoglycemia and everyday effort associated with glucose monitoring and insulin administration. The methods are limited by number of braindead donors and lifelong immunosuppressive treatment. Long term patient and graft survival rafter pancreas transplantation is excellent, resulting in more than 80% of recipient being free of exogenous insulin after 5 years. On the other hand, islet of Langerhans transplantation, as much safe and less invasive treatment, results in lower number of patients, in whom insulin treatment can be stopped.
Key words: pancreas transplantation, islet of Langerhans transplantation, diabetes mellitus
ÚVOD
Standardní léčbou pacientů s diabetes mellitus 1. typu je aplikace inzulinu ve vztahu k množství sacharidů obsažených v jídle tak, aby pacient dosahoval glykemie co nejbližší normálním hodnotám. Ani s pomocí dnes již sofistikovaných technologických postupů pro farmakologickou substituci inzulinu se však zatím nedaří zcela odstranit glykemickou variabilitu a zabránit tak progresi mikrovaskulárních komplikací či vzniku těžkých hypoglykemií.1
V současné době existují pouze dvě dostupné metody, které vedou k normoglykemii, a to transplantace slinivky břišní a transplantace Langerhansových ostrůvků. Principem obou způsobů je přenos orgánů nebo mikroorgánů (ostrůvků) z geneticky nepříbuzného dárce na příjemce. Technika orgánové transplantace je doménou chirurgických oborů a stále ještě přináší nezanedbatelná rizika. Postupy se od sebe mohou lišit typem žilní či arteriální anastomózy a způsobem drenáže pankreatického sekretu.
První transplantaci slinivky provedli 16. prosince 1966 William Kelly a Richard Lillehei v Minnesotě ve Spojených státech amerických. Od té doby do roku 2014 bylo podle mezinárodního registru transplantací pankreatu evidováno více než 48 000 výkonů z celého světa, z toho 28 000 v USA a přibližně 18 000 mimo Spojené státy.3 U nás bylo do konce roku 2018 evidováno více než 700 transplantací slinivky břišní, což Českou republiku řadí v tomto oboru s ohledem na počet obyvatel mezi nejaktivnější země. Ročně podstoupí v IKEM transplantaci 35–40 pacientů.
Podle dat z mezinárodního registru transplantací pankreatu bylo v období 2010–2014 naživu po šesti měsících od transplantace více než 98 % pacientů. V prvním a pátém roce po transplantaci je přežití pacientů 96 a 80 %. Hlavní příčinou úmrtí příjemců zůstávají kardiovaskulární komplikace, zahrnující i cerebrovaskulární příhody, které jsou odpovědné za třetinu všech úmrtí. Roční a tříleté přežití štěpů pankreatu je v kategorii SPK (simultánní transplantace pankreatu a ledviny, simultaneous pancreas and kidney transpalantation) 89 a 82 %. Přežití štěpů ledvin ve stejné kategorii je 95 a 88 %. Ve skupině PTA (izolovaná transplantace slinivky, pancreas transplant alone) přežívá po roce a po třech letech 84 a 75 % štěpů. Ve skupině PTA je zatím přežívání štěpů slinivek o něco horší než při kombinované transplantaci s ledvinou, ale tento rozdíl se postupně stírá. Po roce je funkčních přibližně 80 % štěpů, po třech letech 65 %.3
Nejčastějším důvodem selhání štěpu napříč kategoriemi jsou technické komplikace. Druhou nejčastější příčinou ve skupině SPK je úmrtí s funkčním štěpem. Výsledky transplantací pankreatu v České republice odpovídají výše uvedeným číslům. Nejlepší přežívání pacientů je ve skupině SPK.
Transplantace Langerhansových ostrůvků má za sebou dlouhou a náročnou experimentální historii, ale její klinická aplikace se začala dařit až po roce 2000. Z původně klinické experimentální metody se stal standardní léčebný postup, jehož výsledky jsou dnes hodnoceny v prospektivních randomizovaných studiích. Z historického pohledu se za hlavní změny, které vedly k úspěšným výsledkům považují:
- zavedení semiautomatické metody izolace ostrůvků Ricordim,4
- použití centrifugy COBE 2991 k oddělení ostrůvků od exokrinní tkáně,
- výsledky studie z Edmontonu, které prokázaly až 80% nezávislost na exogenním inzulinu.5
Schéma 1: Algoritmus při výběru transplantační léčby u pacientů s diabetes mellitus 1. typu GF – glomerulární filtrace
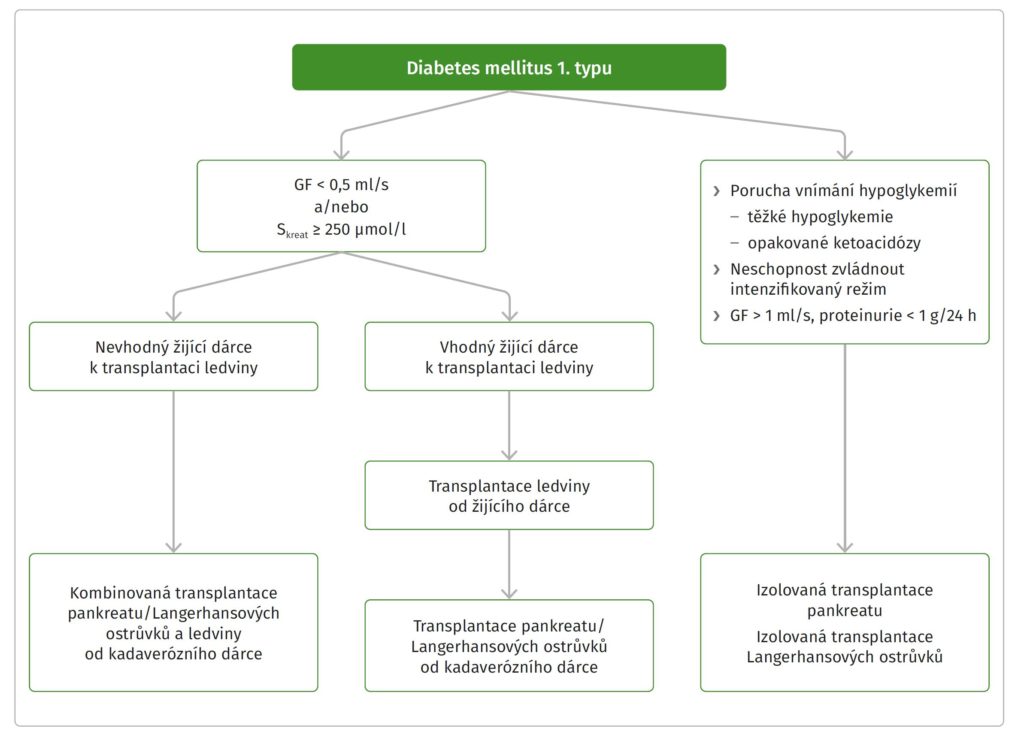 Preferovaným postupem je u všech pacientů zjistit nejdříve možnost transplantace ledviny od žijícího dárce. Pokud je to možné, provede se v prvním kroku transplantace ledviny od žijícího dárce a následně se s časovým odstupem provede transplantace slinivky nebo Langerhansových ostrůvků od kadaverózního dárce. Ostatní pacienti jsou indikováni ke kombinované transplantaci slinivky a ledviny od kadaverózního dárce. V případě, že je pro ně tento výkon spojen s vyšším operačním rizikem, volíme kombinovanou transplantaci ledviny a ostrůvků od kadaverózního dárce. Transplantace samotné ledviny od kadaverózního dárce je z pohledu přežívání pacientů nejméně vhodnou volbou, přichází v úvahu u kandidátů kontraindikovaných k transplantaci inzulin produkující tkáně.
HLAVNÍ INTERAKCE IMUNOSUPRESIVNÍCH LÉČIV
Nevyhnutelnou podmínkou úspěšné transplantační léčby je trvalá blokáda imunitní odpovědí vůči alloantigenům štěpu dárce pomocí imunosuprese. Imunosupresivní léky představují rychle se rozvíjející heterogenní skupinu látek, které mají různý mechanismus účinku. Jejich účinek je zamířen proti T a B lymfocytům jako hlavním nositelům allogenní imunity.
V praxi se většinou používá dělení na imunosupresi indukční, udržovací a antirejekční. Indukční imunosuprese se obvykle skládá z monoklonální či polyklonální protilátky proti lymfocytům a používá se krátkodobě těsně před transplantací a několik dní po transplantaci. Typická udržovací imunosuprese zahrnuje v naprosté většině případů kalcineurinový inhibitor, mykofenolát mofetil/inhibitor mTOR (mammalian target of rapamycine) a malou dávku kortikoidů. Základem antirejekční léčby je pulzní podávání vysokých dávek methylprednisolonu (1,5–3 g rozdělené do několik dávek), v případě rezistence se kortikoidy nahrazují obvykle polyklonální či monoklonální protilátkou proti lymfocytům (antithymocytární globulin, anti‑CD52 – alemtuzumab).9 Kombinace jednotlivých léků, jejich dávkování, délka terapie a udržovací koncentrace léčiv v krvi pak definuje imunosupresivní protokol.
V ambulantní praxi se lze setkat pouze s pacienty s udržovací imunosupresí. Koncentrace takrolimu, cyklosporinu a sirolimu je nutné pravidelně kontrolovat při ambulantních návštěvách. Doporučená rozmezí koncentrací těchto léků v krvi před podáním jsou pro takrolimus a sirolimus 5–10 ng/ml a pro cyklosporin 100–150 ng/ml.10
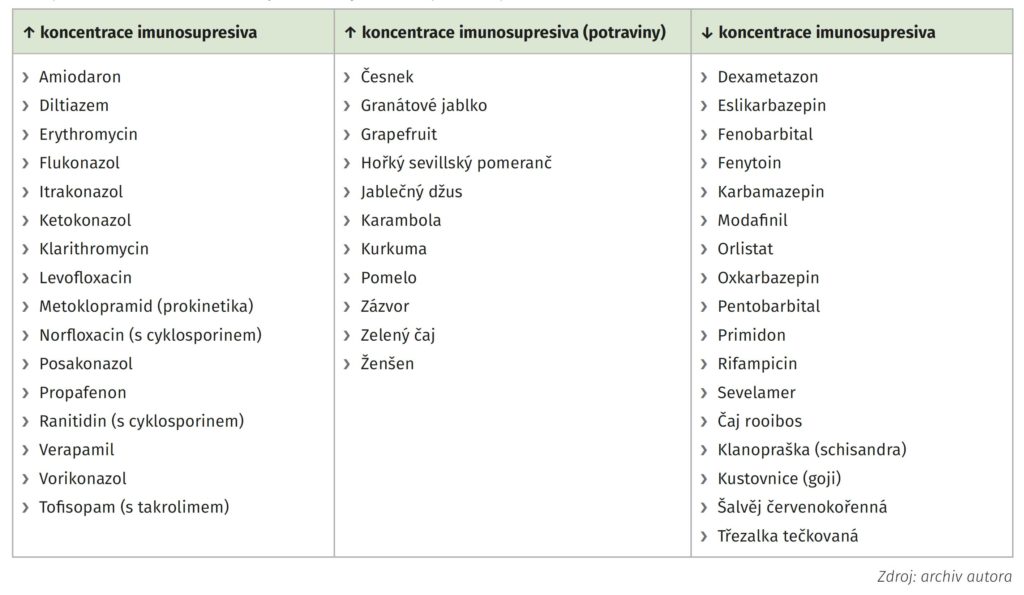
Imunosupresivní léky mohou mít řadu farmakodynamických či farmakokinetických interakcí. Například při podávání makrolidových antibiotik či azolových antimykotik, jež jsou metabolizovány podobným mechanismem, mohou koncentrace kalcineurinových inhibito‑ rů či inhibitorů mTOR mnohonásobně stoupnout, a způsobit tak toxické poškození ledvin a jiných orgánů a enormně tlumit imunitní odpověď. Potenciální interakce je proto třeba znát a dávky imunosupresivních léků upravovat podle výsledků monitorování jejich koncentrace. Nejčastější interakce shrnuje tab.1.
Preferovaným postupem je u všech pacientů zjistit nejdříve možnost transplantace ledviny od žijícího dárce. Pokud je to možné, provede se v prvním kroku transplantace ledviny od žijícího dárce a následně se s časovým odstupem provede transplantace slinivky nebo Langerhansových ostrůvků od kadaverózního dárce. Ostatní pacienti jsou indikováni ke kombinované transplantaci slinivky a ledviny od kadaverózního dárce. V případě, že je pro ně tento výkon spojen s vyšším operačním rizikem, volíme kombinovanou transplantaci ledviny a ostrůvků od kadaverózního dárce. Transplantace samotné ledviny od kadaverózního dárce je z pohledu přežívání pacientů nejméně vhodnou volbou, přichází v úvahu u kandidátů kontraindikovaných k transplantaci inzulin produkující tkáně.
HLAVNÍ INTERAKCE IMUNOSUPRESIVNÍCH LÉČIV
Nevyhnutelnou podmínkou úspěšné transplantační léčby je trvalá blokáda imunitní odpovědí vůči alloantigenům štěpu dárce pomocí imunosuprese. Imunosupresivní léky představují rychle se rozvíjející heterogenní skupinu látek, které mají různý mechanismus účinku. Jejich účinek je zamířen proti T a B lymfocytům jako hlavním nositelům allogenní imunity.
V praxi se většinou používá dělení na imunosupresi indukční, udržovací a antirejekční. Indukční imunosuprese se obvykle skládá z monoklonální či polyklonální protilátky proti lymfocytům a používá se krátkodobě těsně před transplantací a několik dní po transplantaci. Typická udržovací imunosuprese zahrnuje v naprosté většině případů kalcineurinový inhibitor, mykofenolát mofetil/inhibitor mTOR (mammalian target of rapamycine) a malou dávku kortikoidů. Základem antirejekční léčby je pulzní podávání vysokých dávek methylprednisolonu (1,5–3 g rozdělené do několik dávek), v případě rezistence se kortikoidy nahrazují obvykle polyklonální či monoklonální protilátkou proti lymfocytům (antithymocytární globulin, anti‑CD52 – alemtuzumab).9 Kombinace jednotlivých léků, jejich dávkování, délka terapie a udržovací koncentrace léčiv v krvi pak definuje imunosupresivní protokol.
V ambulantní praxi se lze setkat pouze s pacienty s udržovací imunosupresí. Koncentrace takrolimu, cyklosporinu a sirolimu je nutné pravidelně kontrolovat při ambulantních návštěvách. Doporučená rozmezí koncentrací těchto léků v krvi před podáním jsou pro takrolimus a sirolimus 5–10 ng/ml a pro cyklosporin 100–150 ng/ml.10
Imunosupresivní léky mohou mít řadu farmakodynamických či farmakokinetických interakcí. Například při podávání makrolidových antibiotik či azolových antimykotik, jež jsou metabolizovány podobným mechanismem, mohou koncentrace kalcineurinových inhibito‑ rů či inhibitorů mTOR mnohonásobně stoupnout, a způsobit tak toxické poškození ledvin a jiných orgánů a enormně tlumit imunitní odpověď. Potenciální interakce je proto třeba znát a dávky imunosupresivních léků upravovat podle výsledků monitorování jejich koncentrace. Nejčastější interakce shrnuje tab.1.
Tab. 1: Nejčastější interakce léčiv vedoucí ke změně koncentrace takrolimu, sirolimu a cyklosporinu – u všech uvedených léčiv je nutná buď redukce dávky imunosupresiva nejméně o jednu třetinu, nebo kontrola koncentrace léku v krvi
 ZÁVĚR – PERSPEKTIVY TRANSPLANTAČNÍ LÉČBY
Transplantační léčba u pacientů s diabetes mellitus 1. typu je limitována, stejně jako u jiných typů transplantací, počtem dárců v populaci. Optimálních orgánů (slinivek) vhodných k transplantaci je přibližně 60 za rok. Proto je i výběr pacientů k transplantaci omezen na ty, pro které je transplantace životně důležitou léčbou.
Nedostatek orgánů vhodných k transplantaci nutí hledat jiné a nové způsoby náhrady funkce β‑buněk. Nadějně se jeví kultivace nebo spíše transdiferenciace jiných typů buněk na buňky produkující inzulin. Největší zájem budí tzv. lidské pluripotentní kmenové buňky, a to jednak embryonální kmenové buňky a jednak indukované pluripotentní kmenové buňky. V literatuře je popsáno několik protokolů, které by žádoucí diferenciaci těchto buněk na buňky podobné β‑buňkám mohly umožnit. Tyto diferenciované buňky nemají plnou schopnost produkovat inzulin ve stejném rozsahu jako zralé lidské β‑buňky, a proto se nazývají v angličtině „β‑like cells“. Výsledky experimentů jsou sice povzbudivé, nicméně čas k jejich testování v rámci klinických studií zatím stále nenastal. Je nutno zmínit, že hlavním rizikem použití této léčby je vznik nádorů, zejména teratomů.
Jinou možností je příprava bioartificiálního pankreatu enkapsulací β‑buněk nebo použitím nativní extracelulární pankreatické matrix. Bohatým zdrojem β‑buněk by se mohly stát také ostrůvky získané z prasečích pankreatů.
Všechny tyto metody se dále rozvíjejí a budoucnost ukáže, která z nich bude pro léčbu diabetu nejvhodnější. Do praxe se pravděpodobně dostanou také automatické systémy podávání inzulinu v závislosti na naměřené koncentraci glukózy. Předčit přirozenou autoregulaci sekrece inzulinu v β‑buňkách pankreatu, řízenou mnoha biochemickými parametry, která probíhá i bez našeho vědomí, se ale zřejmě nepodaří.
LITERATURA
ZÁVĚR – PERSPEKTIVY TRANSPLANTAČNÍ LÉČBY
Transplantační léčba u pacientů s diabetes mellitus 1. typu je limitována, stejně jako u jiných typů transplantací, počtem dárců v populaci. Optimálních orgánů (slinivek) vhodných k transplantaci je přibližně 60 za rok. Proto je i výběr pacientů k transplantaci omezen na ty, pro které je transplantace životně důležitou léčbou.
Nedostatek orgánů vhodných k transplantaci nutí hledat jiné a nové způsoby náhrady funkce β‑buněk. Nadějně se jeví kultivace nebo spíše transdiferenciace jiných typů buněk na buňky produkující inzulin. Největší zájem budí tzv. lidské pluripotentní kmenové buňky, a to jednak embryonální kmenové buňky a jednak indukované pluripotentní kmenové buňky. V literatuře je popsáno několik protokolů, které by žádoucí diferenciaci těchto buněk na buňky podobné β‑buňkám mohly umožnit. Tyto diferenciované buňky nemají plnou schopnost produkovat inzulin ve stejném rozsahu jako zralé lidské β‑buňky, a proto se nazývají v angličtině „β‑like cells“. Výsledky experimentů jsou sice povzbudivé, nicméně čas k jejich testování v rámci klinických studií zatím stále nenastal. Je nutno zmínit, že hlavním rizikem použití této léčby je vznik nádorů, zejména teratomů.
Jinou možností je příprava bioartificiálního pankreatu enkapsulací β‑buněk nebo použitím nativní extracelulární pankreatické matrix. Bohatým zdrojem β‑buněk by se mohly stát také ostrůvky získané z prasečích pankreatů.
Všechny tyto metody se dále rozvíjejí a budoucnost ukáže, která z nich bude pro léčbu diabetu nejvhodnější. Do praxe se pravděpodobně dostanou také automatické systémy podávání inzulinu v závislosti na naměřené koncentraci glukózy. Předčit přirozenou autoregulaci sekrece inzulinu v β‑buňkách pankreatu, řízenou mnoha biochemickými parametry, která probíhá i bez našeho vědomí, se ale zřejmě nepodaří.
LITERATURA
- Saudek F. Syndrom porušeného vnímaní hypoglykémií a možnosti jeho léčby. Praha: Remedia, 2013;7.
- Boggi U, Vistoli F, Signori S, et al. Outcome of 118 pancreas transplants with retroperitoneal portal‑enteric drainage. Transplantation Proceedings 2005;7:2648–2650.
- Gruessner AC, Gruessner RW. Pancreas transplantation of US and Non‑US cases from 2005 to 2014 as reported to the United Network for Organ Sharing (UNOS) and the International Pancreas Transplant Registry (IPTR). Review of Diabetic Studies 2016;13:35–58.
- Ricordi C, Lacy PE, Finke EH, Olack BJ, Scharp DW. Automated method forisolation of human pancreatic islets. Diabetes 1988;37:413–420.
- Shapiro AM, Lakey JR, Ryan EA, et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid‑free immunosuppressive regimen. New Engl J Med 2000;343:230–238.
- Voglová B, Zahradnická M, Girman P, et al. Benefits of islet transplantation as an alternative to pancreas transplantation: Retrospective study of more than 10 ten years of experience in a single center. Review of Diabetic Studies 2017;14:10–21.
- Choudhary P, Rickels MR, Senior PA, et al. Evidence‑informed clinical practice recommendations for treatment of type 1 diabetes complicated by problematic hypoglycemia. Diabetes care 2015;38(6):1016–1029.
- Othonos N, Choudhary P. Who should be considered for islet transplantation alone? Current Diabetes Reports 2017;17:23.
- Redfield RR, Kaufman DB, Odorico JS. Diagnosis and treatment of pancreas rejection. Current Transplantation Reports 2015;2:169–175.
- Ciancio G, Sageshima J, Chen L, et al. Advantage of rapamycin over mycophenolate mofetil when used with tacrolimus for simultaneous pancreas kidney transplants: Randomized, single‑center trial at 10 years. American Journal of Transplantation 2012;12:3363–3376.



