Možnosti diagnostiky a léčby proteinurie
MUDr. Jan Vachek
Klinika nefrologie 1. LF UK a Všeobecné fakultní nemocnice v Praze
Interní oddělení Klatovské nemocnice a. s.
Abstrakt
Proteinurie není jen kardinálním symptomem primárních a sekundárních nefropatií, ale i samostatným patogenetickým faktorem progrese těchto onemocnění. Spolu s hodnotou sérového kreatininu, hodnocením erytrocytů v moči a sonografií ledvin patří kvalitativní a kvantitativní údaj o proteinurii k základním nefrologickým vyšetřením. Ke screeningu proteinurie se v běžné praxi užívá vyšetření testovacím proužkem – „dipstick, tím však nelze odhalit malou albuminurii, Bence-Jonesovu proteinurii (volné lehké řetězce např. při mnohočetném myelomu) a známky tubulointersticiálních onemocnění. Pro přesnější vyhodnocení albuminurie, resp. proteinurie lze doporučit vyšetření poměru koncentrací albuminu/kreatininu ve vzorku moči, případně vyšetření odpadu bílkovin v moči za 24 hodin.
Cílem sdělení je podat lékařům mimo obor nefrologie stručnou informaci o tomto důležitém příznaku různých renálních i extrarenálních onemocnění a současně informovat o některých pokrocích v jejich diagnostice a terapii v posledních letech – z pohledu nefrologa pečujícího o dospělé pacienty.
Klíčová slova: proteinurie, albuminurie, chronické onemocnění ledvin, ACE inhibitory, sartany, SGLT2 inhibitory (inhibitory sodíko-glukózového transportéru 2)
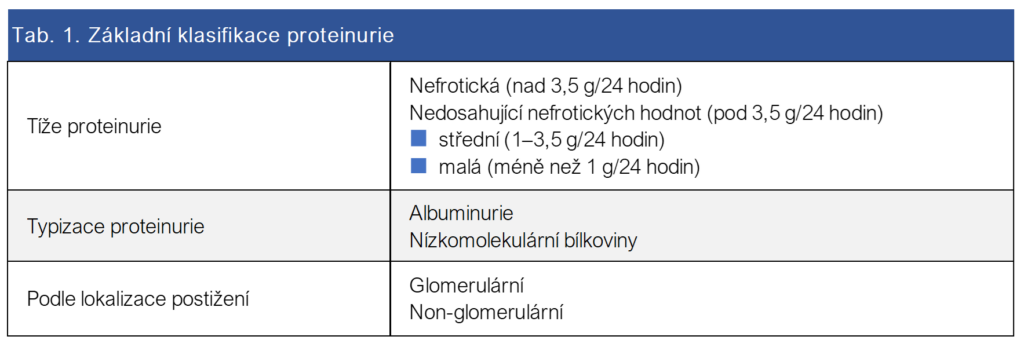
Zdravý dospělý člověk vylučuje denne močí do 150 mg bílkovin, z čehož největší část představuje uromodulin1 (Tamm-Horsfallův protein) a imunoglobulin A. Za normálních okolností je tedy v moči přítomno jen zcela minimální množství plazmatických bílkovin. Pro velké bílkovinné molekuly (napr. IgG) a středně velké bílkovinné molekuly s negativním nábojem (napr. albumin) je glomerulární bazální membrána za normálních okolností prakticky nepropustná. Malé bílkovinné molekuly (napr. alfa 1 mikroglobulin) procházejí glomerulární membránou volně, v tubulech jsou štěpeny a zpětně resorbovány. Z kvalitativního vyšetření močových bílkovin lze proto usuzovat na typ renálního poškození. Přehled základního rozdělení proteinurie uvádí tabulka 1.
Tab. 1.: Základní klasifikace proteinurie
Ve většině případů je proteinurii možno zaradit do jedné z následujících kategorií uvedených v tabulce 2.
Tab. 2: Hlavní typy proteinurie
Etiologie proteinurie
Proteinurie je významnou součástí močového nálezu u většiny primárních glomerulopatií, a to jak proliferativních (nejc časteji IgA nefropatie, membranoproliferativní glomerulonefritida), tak neproliferativních (nefrotický syndrom s minimálními změnami glomerulu, fokálne segmentální glomeruloskleróza, membranózní nefropatie, fibrilární a imunotaktoidní glomerulonefritida). Ze sekundárních glomerulopatií jde o systémové vaskulitidy (ANCAasociovaná vaskulitida, Henoch-Schonleinova purpura = nověji IgA vaskulitida atd.) a dalsí systémová onemocnení (arteriální hypertenze ve stadiu orgánových komplikací, diabetes mellitus, amyloidóza, nemoci z lehkých řetězců – mnohočetný myelom). Tíže proteinurie a její kombinace s tíží erytrocyturie umožňuje do jisté míry predikovat typ glomerulární léze, nemůže však nahradit bioptickou diagnózu.
Přesto v posledních letech byla identifikována řada různých sérových markerů, které v kombinaci s močovým nálezem a odpovídající anamnézou mohou přispět ke stanovení diagnózy bez nutnosti renální biopsie. Např. jde o membranózní nefropatii spojenou s pozitivitou autoprotilátek anti PLA2R (protilátky proti fosfolipáze 2).
Vyšetřovací postup u proteinurie
Pri vyšetřování proteinurie má zásadní význam kvalitní odběr anamnézy s fyzikálním vyšetrřením, anamnestické údaje zahrnují:
Změny vzhledu moči (zpěněná, kalná, krvavá moč), sekrece z močové trubice, vaginální fluor toto může vést k úvaze o kontaminaci, zánětlivém původu proteinurie. Zpěněná moč je však suspektní z masívní proteinurie.
Celkové příznaky (horečky, noční pocení, váhový úbytek, bolesti skeletu) známky kompatibilní se zánětlivým stavem (pyelonefritida) jsou obvykle dramatické, naopak známky systémového onemocnění jako např. bolesti skeletu, bledý vzhled při anémii musí vést k suspekci na mnohočetný myelom.
Další komplikace nefrotického syndromu (otoky, hypertenze, hyperlipoproteinemie)
Relevantní údaje z osobní anamnézy (hepatitidy, infekce, systémová onemocnení, kloubní symptomatologie, hypertenze, hypercholesterolemie, diabetes mellitus)
Kontakt s infekcí
V praxi patří k základním vyšetřovacím metodám vyšetření testovacím proužkem. Je však nutné znát limity tohoto vyšetření – detekuje spolehlivě pouze albumin, nízkomolekulární proteiny (lehké řetězce imunoglobulinu, tzv. Bence-Jonesova bílkovina pri mnohočetném myelomu) zachyceny nejsou, stejně jako albuminurie pod 150 mg albuminu/den. Při vstupním nebo podrobnějším vyšetřování lze proto doporučit současné vyšetření odpadu moči ve 24-hodinovém sběru nebo vyšetření poměru bílkovina/kreatinin či albumin/kreatinin v ranním (nebo kterémkoli) vzorku moči.
Albuminurie je především u pacientů s arteriální hypertenzí a diabetem mellitem citlivějším markerem renálního poškození než celková proteinurie. Vyšetřování albuminurie je již více let standardem v managementu těchto onemocnění.
Od 24-hodinového sběru moči se však v posledních letech ustupuje pro chybovost na straně pacienta, ale i na straně personálu (např. v nemocnici). Proto je již jednoznačně v praxi preferováno stanovování poměru albuminu vůči kreatininu v moči (a proteinu/kreatininu), což je nezatěžující, proveditelné z libovolného vzorku a dobře porovnatelné v čase. Určitým problémem může být existence různých jednotek. Pokud nálezy pocházejí z různých laboratoří, je třeba se přesvědčit, zda byly užity stejné jednotky.
Určení albuminurie pomocí stupňů tíže (A1, A2, A3) – viz tabulka 3 – bylo zavedeno do standardní nomenklatury chronického onemocnění ledvin, vedle úrovně renální funkce a pravděpodobné či diagnostikované příčiny onemocnění ledvin.
Tabulka 3: Kategorie albuminurie a proteinurie podle tíže a porovnání různých jednotek

Nedílnou součástí vyšetřovacího programu je základní biochemické a hematologické vyšetření, zahrnující mj. ostatní parametry nefrotického syndromu (hyperlipoproteinemie, hypoproteinemie).
Vyšetření proteinurie v laboratoři je založeno buď na denaturaci bílkovin kyselinou sulfosalicylovou nebo trichloroctovou a turbidimetrickém měření zákalu, nebo na vazbě barviv na bílkoviny.
V případe těžší proteinurie s rychlou progresí nebo bez jasných anamnestických údajů (hypertenze, diabetes mellitus) je indikováno podrobnější vyšetření včetně sérologických a imunologických vyšetření, výběroveě pak typizace proteinurie (elektroforéza močových bílkovin, SDS-PAGE). Ačkoli byly v poslední době identifikovány autoprotilátky specifické pro některá renální onemocnění (např. zmíněné protilátky anti PLA 2R u idiopatické membranózní nefropatie), zůstává dosud ve většině případů k definitivímu určení renoparenchymatózního onemocnení (glomerulopatie nebo tubulointersticiální léze) nezbytné provedení renální biopsie s morfologickým vyšetřením bioptického vzorku, ideálně specializovaným nefropatologem, to vše v korelaci s aktuálním klinickým a laboratorním nálezem.
Každý pacient s perzistující proteinurií nad 0,5g/24 hodin by měl být vyšetrřen nefrologem, aby byla pokud možno zjištěna příčina proteinurie. Ani izolovaná malá proteinurie nevylučuje závažné onemocnění ledvin (napr. IgA nefropatii, nebo Fabryho chorobu), které může (pokud není včas diagnostikováno a léčeno) progredovat do chronického selhání ledvin.
Z pohledu nefrologa je třeba uvést, že díky pokrokům v posledních letech lze řadu dosud obtížně léčitelných renálních příčin proteinurie úspěšně léčit (zejména diabetické onemocnění ledvin, IgA nefropatii, další glomerulopatie).
Literatúra
- Hirt-Minkowski P, Burkhalter F, Dickenmann M. Proteinurie – Bedeutung und diagnostisches Vorgehen. Ther Umsch. 2013 May;70(5):296-303. German. doi: 10.1024/0040-5930/a000406. PMID: 23619183.
- Sidler D, Huynh-Do U. Urindiagnostik im 21. Jahrhundert: alles andere als obsolet! [Urinalysis in the 21st century: anything but obsolete!]. Praxis (Bern 1994). 2015 Mar 25;104(7):349-52. German. doi: 10.1024/1661-8157/a001962. PMID: 25804777
- Pallet N, Bastard JP, Claeyssens S, Fellahi S, Delanaye P, Piéroni L, Caussé E; groupe de travail SFBC, SFNDT, SNP. Proteinuria typing: how, why and for whom? Ann Biol Clin (Paris). 2019 Feb 1;77(1):13-25. English. doi: 10.1684/abc.2018.1401. PMID: 30799294.
- Burton C, Harris KP. The role of proteinuria in the progression of chronic renal failure. Am J Kidney Dis. 1996 Jun; 27(6): 765–775.
- Jackson CE, Solomon SD, Gerstein HC, et al. Albuminuria in chronic heart failure: prevalence and prognostic importance. Lancet. 2009 Aug 15; 374(9689): 543–550.
- Sandsmark DK, Messé SR, Zhang X, et al. Proteinuria, but Not eGFR, Predicts Stroke Risk in Chronic Kidney Disease: Chronic Renal Insufficiency Cohort Study. Stroke. 2015 Aug; 46 (8): 2075–2080.
- Viklický O., Tesař V. Et al.: Klinická nefrologie. Grada: Praha 2015.
- Zima T et al.: Doporučení ČNS a ČSKB ČLS JEP k diagnostice chronického onemocnění ledvin (odhad glomerulární filtrace a vyšetřování proteinurie). Postgraduální 2021, roč. 19, č. 3, s. 30-39
- Bailey CJ, Day C, Bellary S. Renal Protection with SGLT2 Inhibitors: Effects in Acute and Chronic Kidney Disease. Curr Diab Rep. 2022 Jan;22(1):39-52. doi: 10.1007/s11892-021-01442-z. Epub 2022 Feb 3. PMID: 35113333; PMCID: PMC8888485.
- Podracká Ľ, Šašinka M, Kováčová A, Böör A, Filka J. Lyzozymúria – jednoduchá metóda na dôkaz tubulointersticiálneho poškodenia obličiek. Detský Lekár 1994;1(4): 149–150.