Deintenzifikace na fixní směs inzulinu glargin a lixisenatidu jako cesta k moderní antidiabetické terapii osob s diabetes mellitus 2. typu
MUDr. Milan Flekač, Ph.D. III. interní klinika VFN a 1. LF UK, Praha
Souhrn V současné době máme k dispozici tzv. fixní kombinační injekční léčbu (FRC), což znamená, že pacient aplikuje jedním aplikátorem agonistu receptoru pro GLP-1 (GLP-1 RA) i bazální inzulinový analog pouze jedenkrát denně. Řada pacientů na intenzifikované inzulinové terapii (IIT) nedosahuje cílových hodnot ukazatelů kompenzace diabetu při složitém inzulinovém režimu s řadou omezení v běžném životě. Článek prezentuje zkušenost z reálné klinické praxe u osob, které byly léčeny IIT a převedeny na moderní režim FRC, tedy tzv. deintenzifikaci. V tomto případě byla použita fixní směs glarginu 100 U/ml a GLP-1 RA lixisenatdu, tedy IGlarLixi. Jedná se o retrospektivní analýzu dat z ambulantních záznamů. Během 3 měsíců došlo k poklesu HbA1c o 2,25 mmol/mol (95% CI: –3,83 až –0,67), p < 0,05, významně se také snížila celková denní dávka inzulinu o 7,8 IU/den (95% CI: –13,7 až –1,9), p < 0,05 a významně se zvýšil komfort pacientů snížením počtu aplikací za den i výskyt hypoglykemií. Deintenzifikace tak má potenciál u řady osob s diabetes mellitus 2. typu zlepšit kvalitu života a komfort oproti zavedeným složitým inzulinovým režimům. Klíčová slova: deintenzifikace, fixní kombinační injekční léčba, IGlarLixi, reálná praxe Summary At present, the socalled fixedratio combination therapy (FRC) is available, which allows to apply a GLP-1 receptor agonist (GLP-1 RA) and a basal insulin analogue together using one injector once a day. Many patients treated with multiple dose insulin therapy (MDI) do not meet the targets in spite of following complex insulin regimen with a number of limitations in everyday life. This article presents the real-life evidence in people who were treated with MDI in history and transferred to the FRC regimen, thus underwent deintensification. Fixed mixture of glargine 100 U/ml and GLP-1 RA lixisenatide, IGlarLixi, was used. It is a retrospective analysis of data from medical records. Within 3 months there was a slight decrease in HbA1c by 2.25 mmol/mol (95% CI: –3.83 to –0.67), p < 0.05, the total daily dose of insulin decreased by 7.8 IU/day (95% CI: –13.7 to –1.9), p < 0.05, and patient comfort was significantly increased by reducing the number of applications per day and the incidence of hypoglycaemia decreased. Deintensification has a potential to improve quality of life and comfort in many people with type 2 diabetes mellitus overtreated by complex insulin regimens. Keywords : deintensification, fixedratio combination therapy, IGlarLixi, real life evidence Úvod Jedním ze základních cílů léčby osob s diabetes mellitus 2. typu (DM2) je vedle prodloužení života také udržení či zlepšení kvality života s diabetem. Léčba diabetu, zejména injekční, jistě do kvality života a pohodlí pacientů významným způsobem negativně zasahuje. Zejména se jedná o situaci, kdy je nutné s ohledem na dlouhodobě neuspokojivou kontrolu diabetu přistoupit k revizi antidiabetické léčby intenzifikací, zvláště zahájením intenzifikované inzulinové terapie (IIT) u osob dosud léčených kombinací perorálních antidiabetik s maximálně jednou denní dávkou dlouhodobě působícího inzulinu. Ještě před několika lety byla iniciace IIT v této situaci jedinou možností. Příchod agonistů receptoru pro GLP-1 (GLP-1 RA) do klinické praxe znamená významný přínos, mj. právě s ohledem na komplementární působení v kombinační léčbě s bazálním inzulinem. V současné době máme k dispozici nejen oddělené flexibilní podání obou antidiabetik, ale i tzv. fixní kombinační injekční léčbu (FRC), kdy si pacient aplikuje jedním aplikátorem GLP-1 RA i bazální inzulinový analog pouze jedenkrát denně. Právě přechod na FRC ve výše uvedené situaci selhávající léčby bazálním inzulinem a perorálními antidiabetiky je dnešní alternativou dřívější IIT.1 Jak ukazují klinické studie, toto řešení představuje podobně účinný prostředek kontroly glykemie jako IIT, ale s významně vyšší bezpečností, tedy nižším výskytem hypoglykemie, jednoduchým školením pacienta edukátory, významným pohodlím (intenzifikace bez přidání vpichu) a minimálními nároky na selfmonitoring glykemií osobním glukometrem.2 Řada pacientů na IIT nedosahuje cílových hodnot a kompenzace diabetu při složitém inzulinovém režimu s řadou omezení v běžném životě. Článek prezentuje zkušenost z reálné klinické praxe u osob, které byly léčeny IIT a byly převedeny na moderní režim FRC, tedy tzv. deintenzifikaci. V tomto případě byla použita fixní směs glarginu 100 U/ml a GLP-1 RA lixisenatidu, tedy IGlarLixi .3 Retrospektivní analýza Jedná se o retrospektivní analýzu dat z ambulantních záznamů 30 osob s DM 2. typu (18 žen a 12 mužů), průměrného věku 68,5 ± 10,8 let, s dobou trvání diabetu 10,6 ± 4,2 let. Ostatní klinické charakteristiky jsou uvedeny v tabulce 1. Dvě osoby byly z důvodu dekompenzace diabetu během prvních 2 týdnů ze souboru vyřazeny a byl navrácen režim IIT (jejich data nebyla dále hodnocena).Tabulka 1: Vývoj sledovaných parametrů od zahájení léčby IGlarLixi po 3 měsících
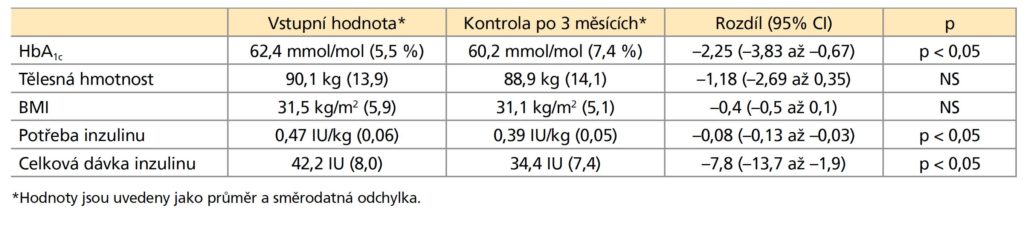 43 % osob bylo před převedením na IGlarLixi léčeno režimem bazál-bolus s humánním inzulinem (alespoň prandiálním či bazálním), 32 % osob bylo léčeno režimem bazál-bolus výhradně analogy inzulinu a 25 % premixovanou směsí inzulinů (obrázek 1). 39 % osob bylo léčeno inzulinem
v kombinaci s metforminem (medián celkové denní dávky metforminu byl 1 000 mg). Průměrný počet aplikací inzulinu za den byl před deintenzifikací 3,5 injekcí/den. V mezidobí probíhala vždy telefonická či e-mailová konzultace klinického stavu a glykemií po 14 dnech od zahájení léčby IGlarLixi.
43 % osob bylo před převedením na IGlarLixi léčeno režimem bazál-bolus s humánním inzulinem (alespoň prandiálním či bazálním), 32 % osob bylo léčeno režimem bazál-bolus výhradně analogy inzulinu a 25 % premixovanou směsí inzulinů (obrázek 1). 39 % osob bylo léčeno inzulinem
v kombinaci s metforminem (medián celkové denní dávky metforminu byl 1 000 mg). Průměrný počet aplikací inzulinu za den byl před deintenzifikací 3,5 injekcí/den. V mezidobí probíhala vždy telefonická či e-mailová konzultace klinického stavu a glykemií po 14 dnech od zahájení léčby IGlarLixi.
Obrázek 1: Zastoupení inzulinových režimů před deintenzifikací
 Převod na fixní směs glarinu a lixisenatidu probíhal ve všech případech ambulantní cestou, v den převodu byl vysazen krátkodobý inzulin před jídly, resp. ukončeno podávání premixované směsi inzulinů, a dle předchozí celkové dávky bazálního inzulinu byla zahájena léčba iniciální dávkou 20, resp. 30 dávkovacích jednotek IGlarLixi jedenkrát denně. Zavedená terapie metforminem byla ponechána ve stejné dávce.
Pacienti obdrželi instrukce k titraci dávek. Titrace probíhala podle průměrné glykemie nalačno, jedenkrát týdně, vždy nejpozději za 2 týdny od převodu pacient kontaktoval lékaře telefonicky. Většina pacientů kontaktovala lékaře telefonicky jedenkrát týdně. Titrační schéma bylo upravováno individuálně, od 2 do 6 jednotek jedenkrát týdně. Pacienti byli instruováni o měření glukometrem, minimálně jeden-krát denně ráno nalačno a vždy při obtížích suspektních z hypoglykemie. Pacienti byli na začátku instruováni, že v případech výskytu příznaků dekompenzace diabetu či při vysokých glykemiích při selfmonitoringu (vyšší než předchozí) mají kontaktovat lékaře ke stanovení dalšího postupu.
Laboratorní a klinická kontrola od zahájení léčby IGlarLixi proběhla cca po 3 měsících. Během této kontroly byla mj. analyzována data z osobních glukometrů pacientů, jak je běžné v klinické praxi. Během ambulantní kontroly byl hodnocen glykovaný hemoglobin (HbA1c), celková denní dávka inzulinu a tělesná hmotnost, byl sledován výskyt nežádoucích účinků, zejména gastrointestinálních, a výskyt hypoglykemií (těžkých i mírných – pod 3,0 mmol/l) na základě údajů ze selfmonitoringu.
Výsledky
Žádný z pacientů nepřerušil terapii z důvodu výskytu gastrointestinálních nežádoucích účinků či nespokojenosti s léčbou. Asi 21 % (6 osob) referovalo
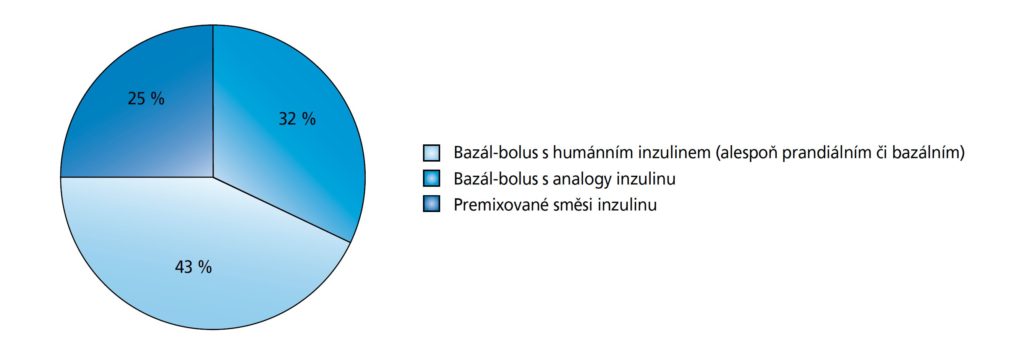
v úvodu mírný výskyt obtíží charakteru nauzey, která během dalšího sledování (asi po 4–6 týdnech) postupně vymizela. Pouze u dvou osob došlo v průběhu prvních 2 týdnů k významnému zvýšení glykemií, zejména postprandiálních, a byly proto převedeny zpět na IIT (data nebyla dále analyzována). Během 3 měsíců došlo ke statisticky významnému poklesu HbA1c o –2,25 mmol/mol (95% CI: –3,83 až –0,67; p < 0,05) (obrázek 2). Tělesná hmotnost se snížila nesignifikantně o –1,18 kg (95% CI: –2,69 až –0,35; p < 0,05) a celková denní dávka inzulinu statisticky významně poklesla o –7,8 IU/den (95% CI: –13,7 až –1,9; p < 0,05). Sníže ním počtu aplikací za den (z 3,5/den na 1/den) se výrazně zvýšil komfort pacientů (tabulka 1).
Převod na fixní směs glarinu a lixisenatidu probíhal ve všech případech ambulantní cestou, v den převodu byl vysazen krátkodobý inzulin před jídly, resp. ukončeno podávání premixované směsi inzulinů, a dle předchozí celkové dávky bazálního inzulinu byla zahájena léčba iniciální dávkou 20, resp. 30 dávkovacích jednotek IGlarLixi jedenkrát denně. Zavedená terapie metforminem byla ponechána ve stejné dávce.
Pacienti obdrželi instrukce k titraci dávek. Titrace probíhala podle průměrné glykemie nalačno, jedenkrát týdně, vždy nejpozději za 2 týdny od převodu pacient kontaktoval lékaře telefonicky. Většina pacientů kontaktovala lékaře telefonicky jedenkrát týdně. Titrační schéma bylo upravováno individuálně, od 2 do 6 jednotek jedenkrát týdně. Pacienti byli instruováni o měření glukometrem, minimálně jeden-krát denně ráno nalačno a vždy při obtížích suspektních z hypoglykemie. Pacienti byli na začátku instruováni, že v případech výskytu příznaků dekompenzace diabetu či při vysokých glykemiích při selfmonitoringu (vyšší než předchozí) mají kontaktovat lékaře ke stanovení dalšího postupu.
Laboratorní a klinická kontrola od zahájení léčby IGlarLixi proběhla cca po 3 měsících. Během této kontroly byla mj. analyzována data z osobních glukometrů pacientů, jak je běžné v klinické praxi. Během ambulantní kontroly byl hodnocen glykovaný hemoglobin (HbA1c), celková denní dávka inzulinu a tělesná hmotnost, byl sledován výskyt nežádoucích účinků, zejména gastrointestinálních, a výskyt hypoglykemií (těžkých i mírných – pod 3,0 mmol/l) na základě údajů ze selfmonitoringu.
Výsledky
Žádný z pacientů nepřerušil terapii z důvodu výskytu gastrointestinálních nežádoucích účinků či nespokojenosti s léčbou. Asi 21 % (6 osob) referovalo
v úvodu mírný výskyt obtíží charakteru nauzey, která během dalšího sledování (asi po 4–6 týdnech) postupně vymizela. Pouze u dvou osob došlo v průběhu prvních 2 týdnů k významnému zvýšení glykemií, zejména postprandiálních, a byly proto převedeny zpět na IIT (data nebyla dále analyzována). Během 3 měsíců došlo ke statisticky významnému poklesu HbA1c o –2,25 mmol/mol (95% CI: –3,83 až –0,67; p < 0,05) (obrázek 2). Tělesná hmotnost se snížila nesignifikantně o –1,18 kg (95% CI: –2,69 až –0,35; p < 0,05) a celková denní dávka inzulinu statisticky významně poklesla o –7,8 IU/den (95% CI: –13,7 až –1,9; p < 0,05). Sníže ním počtu aplikací za den (z 3,5/den na 1/den) se výrazně zvýšil komfort pacientů (tabulka 1).
Obrázek 2: Vývoj sledovaných parametrů od zahájení léčby IGlarLixi po 3 měsících
 V průběhu 3 měsíců léčby nebyl dokumentován výskyt těžké hypoglykemie, pouze u 28,5% pacientů byla dokumentována alespoň 1 hypoglykemie pod 3,0 mmol/l. Výskyt hypoglykemií pod 3,0 mmol/l ve sledovaných 3 měsících byl u všech pacientů redukován v průměru o 45 ± 14 % oproti předchozím 3 měsícům terapie IIT (data byla získána analýzou záznamů glukometrů pacientů během 3 měsíců před zahájením a po zahájení léčby IGlarLixi).
Diskuse
Je zřejmé, že 93 % osob (28 z původních 30) indikovaných k deintenzifikaci na IGlarLixi ze změny profitovalo. Podle záznamů ze selfmonitoringu došlo
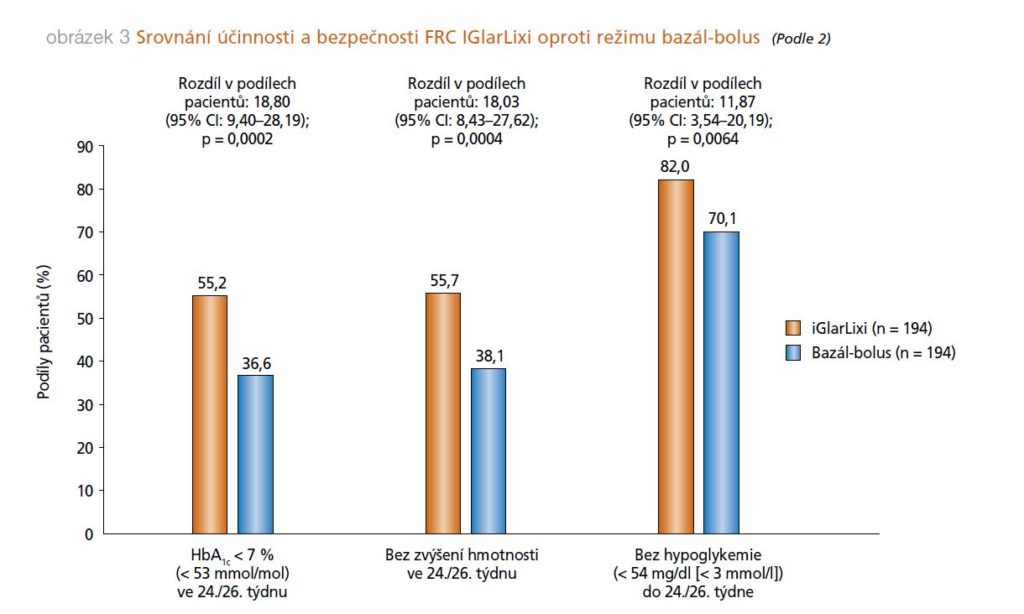
k poklesu výskytu dokumentovaných hypoglykemií, zlepšení kvality života snížením počtu podkožních aplikací inzulinu při zachování či dokonce mírném zlepšení kontroly diabetu (dle HbA1c) a mírném poklesu tělesné hmotnosti. Jedná se o data z reálné praxe, hodnocení výstupů je jistě zatíženo způsobem zpracování dat, jedná se o retrospektivní analýzu. Nicméně potvrzuje výsledky klinických studií srovnávajících IIT oproti kombinační injekční antidiabetické léčbě GLP-1 RA a bazálním inzulinem (obrázek 3). Tato moderní terapie by měla být v případě nutnosti intenzifikovat léčbu bazálním inzulinem preferována před přidáním prandiálního inzulinu, jak je uvedeno i ve společném algoritmu terapie pro DM 2. typu ADA (American Diabetes Association) a EASD ( European Association for the Study of Diabetes) z roku 2019.4
Postupy deintenzifikace nejsou v doporučeních zatím jednoznačně zpracovány, ale byly prezentovány zkušenosti z reálné praxe, které jsou poměrně konzistentní s výstupy klinických hodnocení.5 Pro rozhodnutí, u jakých pacientů indikovat převod na FRC, nejsou k dispozici jednoznačné prediktory úspěchu, resp. selhání. Ze změny mohou pravděpodobně profitovat pacienti se zachovalou endogenní sekrecí inzulinu a s anamnézou hypoglykemií při IIT, dále pacienti, u nichž je zřejmé, že vynechávají aplikace prandiálního inzulinu, aplikují zcela neadekvátně (příliš nízká dávka bolusu, pozdní aplikace po jídle, časté zapomínání aplikace bolusu) nebo neprovádějí strukturovaný selfmonitoring glukometrem.
V průběhu 3 měsíců léčby nebyl dokumentován výskyt těžké hypoglykemie, pouze u 28,5% pacientů byla dokumentována alespoň 1 hypoglykemie pod 3,0 mmol/l. Výskyt hypoglykemií pod 3,0 mmol/l ve sledovaných 3 měsících byl u všech pacientů redukován v průměru o 45 ± 14 % oproti předchozím 3 měsícům terapie IIT (data byla získána analýzou záznamů glukometrů pacientů během 3 měsíců před zahájením a po zahájení léčby IGlarLixi).
Diskuse
Je zřejmé, že 93 % osob (28 z původních 30) indikovaných k deintenzifikaci na IGlarLixi ze změny profitovalo. Podle záznamů ze selfmonitoringu došlo
k poklesu výskytu dokumentovaných hypoglykemií, zlepšení kvality života snížením počtu podkožních aplikací inzulinu při zachování či dokonce mírném zlepšení kontroly diabetu (dle HbA1c) a mírném poklesu tělesné hmotnosti. Jedná se o data z reálné praxe, hodnocení výstupů je jistě zatíženo způsobem zpracování dat, jedná se o retrospektivní analýzu. Nicméně potvrzuje výsledky klinických studií srovnávajících IIT oproti kombinační injekční antidiabetické léčbě GLP-1 RA a bazálním inzulinem (obrázek 3). Tato moderní terapie by měla být v případě nutnosti intenzifikovat léčbu bazálním inzulinem preferována před přidáním prandiálního inzulinu, jak je uvedeno i ve společném algoritmu terapie pro DM 2. typu ADA (American Diabetes Association) a EASD ( European Association for the Study of Diabetes) z roku 2019.4
Postupy deintenzifikace nejsou v doporučeních zatím jednoznačně zpracovány, ale byly prezentovány zkušenosti z reálné praxe, které jsou poměrně konzistentní s výstupy klinických hodnocení.5 Pro rozhodnutí, u jakých pacientů indikovat převod na FRC, nejsou k dispozici jednoznačné prediktory úspěchu, resp. selhání. Ze změny mohou pravděpodobně profitovat pacienti se zachovalou endogenní sekrecí inzulinu a s anamnézou hypoglykemií při IIT, dále pacienti, u nichž je zřejmé, že vynechávají aplikace prandiálního inzulinu, aplikují zcela neadekvátně (příliš nízká dávka bolusu, pozdní aplikace po jídle, časté zapomínání aplikace bolusu) nebo neprovádějí strukturovaný selfmonitoring glukometrem.
Obrázek 3: Srovnání účinnosti a bezpečnosti FRC IGlarLixi oproti režimu bazábolus (Podle 2)
- Haluzík M, Flekač M, Lengyel C, et al. Expert opinion on the therapeutic use of the fixed-ratio combination of insulin glargine 100 U/mL and lixisenatide: a central/eastern european perspective. Diabetes Ther 2020;11(4):1029–43.
- Tabák AG, Anderson J, Aschner P, et al. Efficacy and safety of iGlarLixi, fixed-ratio combination of insulin glargine and lixisenatide, compared with basal-bolus regimen in patients with type 2 diabetes: propensity score matched analysis. Diabetes Ther 2020;11(1):305–18.
- Suliqua – Souhrn informací o přípravku, 2020.
- Buse JB, Wexler DJ, Tsapas A, et al. 2019 Update to: Management of hyperglycemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2020,43(2): 487–93.
- Harreiter J, KosiTrebotic L, Lukas A, et al. Switch to combined GLP1 receptor agonist lixisenatide with basal insulin glargine in poorly controlled T2DM patients with premixed insulin therapy: a clinical observation and pilot study in nine patients. Diabetes Ther 2017;8(3):683–92.



