Glykemická variabilita v centre záujmu
Odborná redakcia DIA News
Glykemická variabilita predstavuje jeden z kľúčových parametrov kontroly glykémie. V minulosti sa diskutovalo o možnom negatívnom vplyve glykemickej variability na mikrovaskulárne a makrovaskulárne komplikácie spojené s diabetom. Od roku 2015 sa objavujú nové štúdie potvrdzujúce negatívny vplyv glykemickej variability aj na celkovú mortalitu a na úmrtia z kardiovaskulárnych príčin u osôb s diabetom 1. alebo 2. typu (Ceriello et al., 2019). Preto nie je prekvapujúce, že aj regulačné úrady čoraz viac presadzujú hodnotenie tohto parametra v rámci klinických štúdií a klinickej praxe (Aronson et al., 2019).

Niektorí autori uvádzajú, že chronická hyperglykémia, epizódy hypoglykémie a glykemická variabilita predstavujú hlavné rizikové faktory vzniku diabetických komplikácií, zvlášť kardiovaskulárnych. Okrem toho, že pôsobia nezávisle ako rizikové faktory diabetických komplikácií, môže dochádzať k ich vzájomnému potencovaniu (Monnier et al., 2012).
Glykemickú variabilitu môžeme formálne rozdeliť z hľadiska dĺžky sledovaného obdobia na tri skupiny (Chehregosha et al., 2019):
a. krátkodobé – časový interval 24 – 72 hodín
b. strednodobé – od troch dní do jedného mesiaca
Zavedenie kontinuálneho monitorovania glykémie (angl. Continuous Glucose Monitoring (CGM)) do klinickej praxe výrazne posunulo hodnotenie glykemickej variability v krátkodobom časovom horizonte u osôb s diabetom, lebo máme príležitosť sledovať priebeh glykémie počas dňa (Battelino et al., 2019).
Podľa medzinárodného konsenzu schváleného American Diabetes Association, American Association of Clinical Endocrinologists, American Association of Diabetes Educators, European Association for the Study of Diabetes, Foundation of European Nurses in Diabetes, International Society for Pediatric and Adolescent Diabetes, Juvenile Diabetes Research Foundation a Pediatric Endocrine Society môžeme hodnotiť kontrolu glykémie s využitím techník CGM s pomocou troch parametrov. Prvý z nich predstavuje čas, keď mal pacient glykémiu v zvolenom cieľovom intervale (angl. time in range (TIR)), na to nadväzuje parameter čas, keď mal pacient glykémiu vyššiu ako stanovený cieľový interval (angl. time above range (TAR)) alebo nižšiu ako stanovený cieľový interval (angl. time below range (TBR)). Minimálna doba sledovania by mala byť aspoň desať celých dní. Uvedené tri parametre sa zvyknú vyjadrovať vo forme percentuálnych bodov (%), koľko % zo dňa počas sledovaného časového obdobia sa hodnoty glykémie nachádzali v danom cieľovom intervale (TIR), nad cieľovým intervalom (TAR) alebo pod cieľovým intervalom (TBR). Voľba cieľového intervalu pre daného pacienta odráža jednak kritériá medzinárodných odporúčaní, ale tiež by mala zohľadniť aj individuálne možnosti pacienta (Battelino et al., 2019; Dovc & Battelino, 2021).
Podľa už spomenutého konsenzu pre pacientov s diabetom 1. typu alebo 2. typu sa odporúčajú hodnoty TIR v intervale 3,9 – 10,0 mmol/l, TBR < 3,9 mmol/l a TAB ˃10,0 mmol/l. Počas dňa by sa mali glykémie u pacientov s DM 1 alebo DM 2 nachádzať ˃70 % času (˃16 hod. 48 min.) v TIR zóne, < 4 % času (< 1 hod.) v TBR zóne a < 25 % času (< 6 hod.) v TAR zóne. Pre seniorov alebo vysoko rizikových pacientov s DM 1 alebo DM 2 sú hodnoty upravené takto: ˃ 50 % času v TIR zóne, < 1 % v TBR zóne a < 10 % v TAR zóne. Každé zvýšenie parametra TIR o 5 % (percentuálne body) vedie ku klinicky významnému zlepšeniu liečby diabetu (Battelino et al., 2019; Dovc & Battelino, 2021).
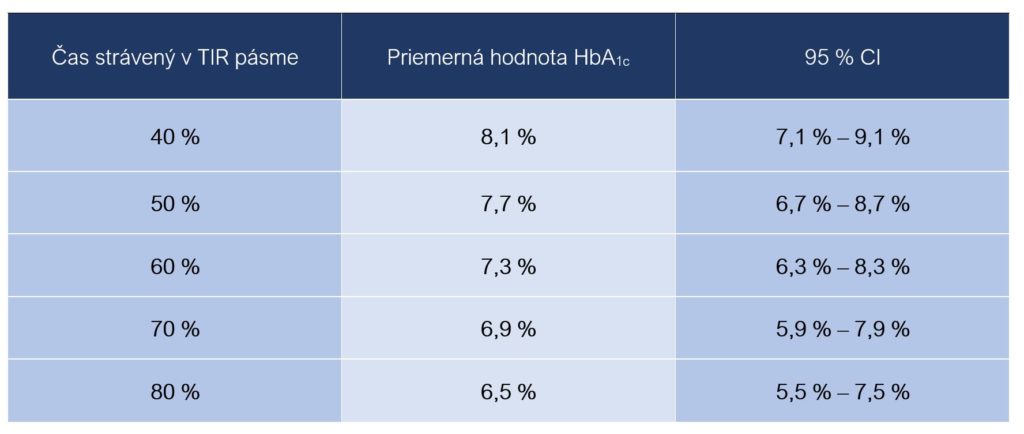
Vzťah medzi priemerným časom stráveným v TIR pásme počas dňa (vyjadrený v %) a priemernými hodnotami glykozylovaného hemoglobínu HbA1c ukazuje nasledujúca tabuľka. Uvedené údaje platia v prípade diabetu 1. typu a aj 2. typu (Beck et al., 2017; Quang, 2019):
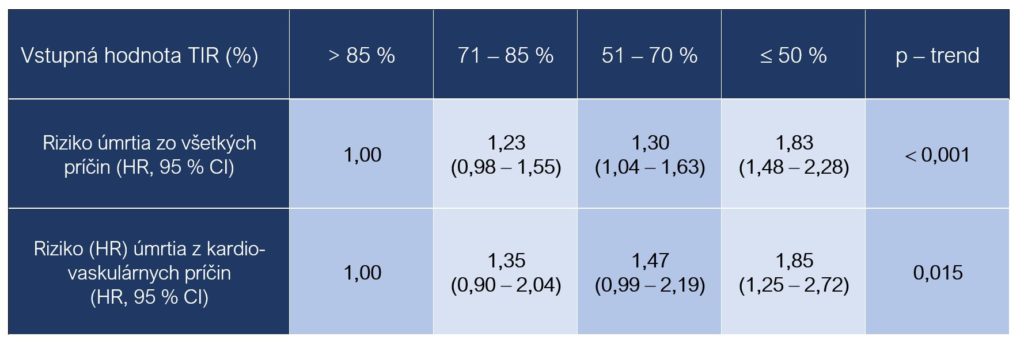
Z novších štúdií, ktoré hodnotili význam parametra TIR z hľadiska rizika úmrtia zo všetkých príčin a zvlášť kardiovaskulárnej mortality, je zaujímavá prospektívna kohortná štúdia, do ktorej bolo zaradených 6 225 osôb s diabetom 2. typu (priemerný vek 61,7 ± 11,9, 54,7 % muži, priemerná vstupná hodnota HbA1c 8,9 ± 2,2 %, trvanie ochorenia v priemere 9,7 ± 7,4 roka). Pacienti boli rozdelení na základe nameraných hodnôt TIR (tri dni po sebe na štandardnej diéte) v čase zaradenia do štúdie do štyroch skupín > 85 %, 71 – 85 %, 51 –70 % a £ 50 %. Počas sledovaného obdobia, mediánu 6,9 rokov bolo v štúdii zaznamenaných 838 úmrtí, z toho 287 prípadov bolo vyhodnotených ako úmrtia z kardiovaskulárnych príčin (Lu et al., 2021).
Výsledky potvrdili negatívny vplyv nižších hodnôt TIR z hľadiska hodnotenia rizika (HR, Hazard Ratio) úmrtia zo všetkých príčin a kardiovaskulárnej mortality. Hodnota TIR > 85 % predstavuje referenčnú hodnotu (Lu et al., 2021):
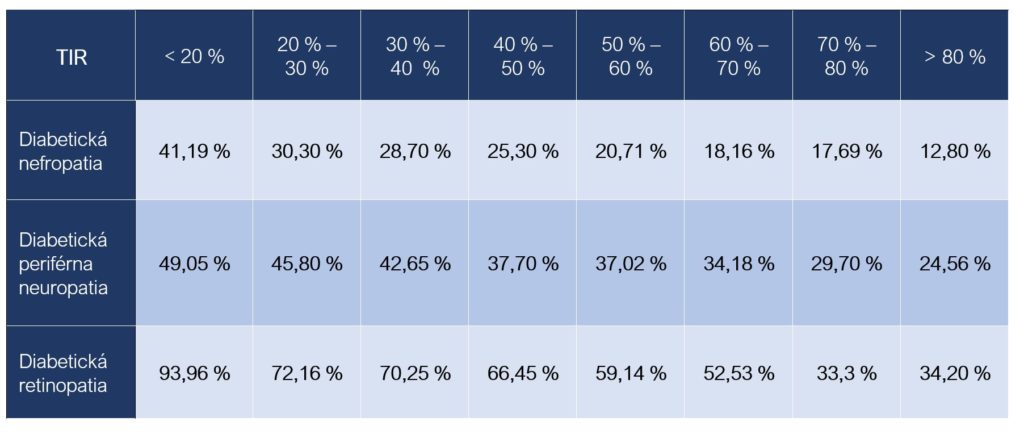
Kvantifikovať vzťah medzi hodnotami TIR a výskytom komplikácií u osôb s diabetom sa pokúsila štúdia sledujúca 3 408 osôb s DM 2 (55,6 % muži, priemerný vek 59,74 ± 13,40 rokov, priemerná doba trvania ochorenia 8,28 ± 7,11 rokov a priemerné hodnoty HbA1c 8,92 ± 2,49 %). Z uvedeného počtu bola 380 osobám diagnostikovaná diabetická nefropatia, 1 296 diabetická periférna neuropatia a 2 077 osobám diabetická retinopatia. Hodnoty TIR sa počítali zo sedembodového glykemického profilu meraného prvé tri po sebe nasledujúce dni počas hospitalizácie (Sheng et al., 2021).
Vzťah medzi hodnotami TIR a frekvenciou výskytu vybraných diabetických komplikácií (Sheng et al., 2021):
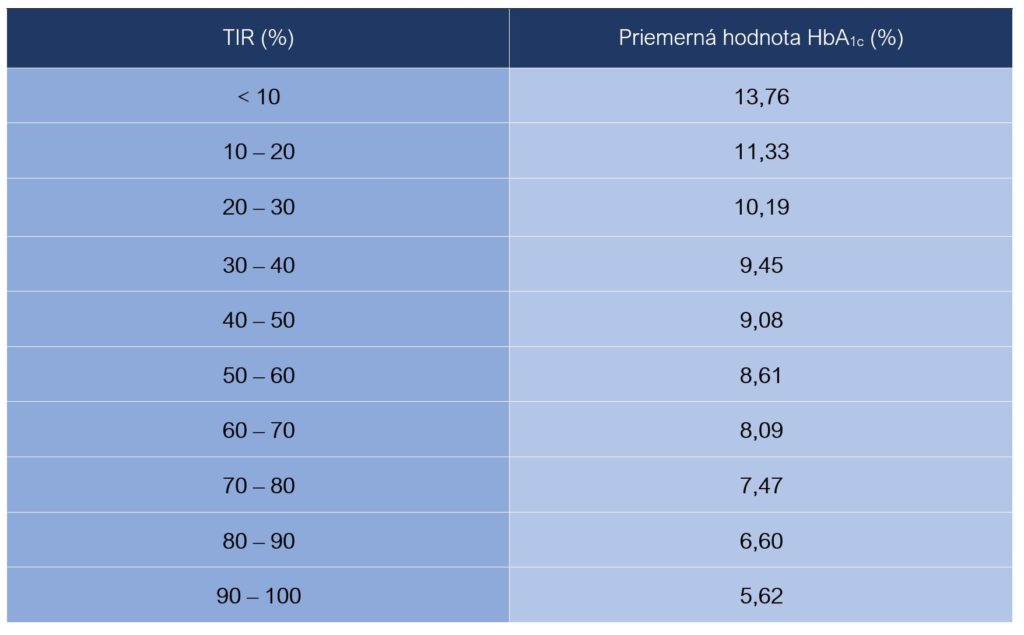
Epidemiologická štúdia taktiež potvrdila štatisticky signifikantnú koreláciu medzi hodnotami TIR meranými počas prvých troch po sebe nasledujúcich dní počas hospitalizácie a priemernými hodnotami HbA1c (Sheng et al., 2020):
Korelácia medzi časom stráveným v TIR pásme a výskytom mikrovaskulárnych diabetických komplikácií u osôb s DM 2 bola predmetom aj systematického review publikovaného tohto roku. Podľa autorov ide o prvú publikovanú prácu venovanú uvedenej problematike. Práca analyzovala 11 štúdií s celkovým počtom 13 987 zaradených osôb – priemerný vek v čase zaradenia do štúdie 59,3 ± 1,3 roka, priemerná východisková hodnota HbA1c 8,2 ± 0,5 % a priemerná doba trvania ochorenia 11,3 ± 1,0 roka. Výsledky ukázali, že zvýšenie času stráveného v TIR pásme o 10 % klinicky významne znížilo výskyt a/alebo progres albuminúrie, progres závažných foriem diabetickej retinopatie, výskyt bolestivej diabetickej neuropatie a kardiálnej autonómnej neuropatie (Raj et al., 2022).
Určite je zaujímavé zistenie, že ak osoba s diabetom vníma zníženie glykemickej variability ako niečo prínosné, vedie to k zvýšenej kvalite jej života, čo sa pozitívne prejaví napríklad na zvýšení spokojnosti s liečbou diabetu, zvýšením produktivity práce alebo znížením počtu absencií v práci (Umpierrez & Kovatchev, 2018).
Možnými mechanizmami zodpovednými za negatívny vplyv glykemickej variability na riziko vzniku a rozvoj komplikácií spojených s diabetom môže byť oxidatívny stres a fluktuácia hormónov (Zhou et al., 2020). Ďalej treba brať do úvahy vplyv glykemickej variability na stabilitu aterosklerotického plátu a potencovanie subklinickej formy koronárnej aterosklerózy (Gu et al., 2018; Ceriello et al., 2019; Singleton et al., 2020).
Rozvoj nových poznatkov o fyziologickej, resp. patofyziologickej úlohe glykemickej variability zákonite vedie k otázke, ako ovplyvniť glykemickú variabilitu u osôb s diabetom. Súčasné poznatky ukazujú na niekoľko ciest, ako znížiť variabilitu glykémie. Jednou z nich je voľba vhodného diétneho režimu založeného na príjme potravín s nízkym obsahom cukrov. V štúdiách sa porovnával účinok potravín s nízkym obsahom cukrov samostatne alebo v kombinácii s potravinami s vysokým obsahom tukov vs potravín s vysokým obsahom cukrov. Potraviny s nízkym glykemickým indexom znižujú glykemickú variabilitu a zvyšujú oxidáciu tukov (Zhou et al., 2020). Nedávno publikované práce u osôb s prediabetom a diabetom 2. typu poskytli zaujímavé výsledky. Ukazuje sa, že dôležité je nielen zloženie konzumovanej stravy, ale aj poradie príjmu potravín. Optimálne je konzumovať najprv bielkoviny alebo zeleninu a potom cukry. Autori konštatujú, že v bežnom živote uvedené zistenia znamenajú, že je vhodné konzumovať zeleninu a bielkoviny spolu na začiatku obeda alebo večere a potom asi po desiatich minútach prejsť k cukrom. Druhým možným variantom je začať so zeleninou a potom by mohla nasledovať kombinácia bielkoviny a cukry spolu. Jednoducho povedané, začínajme vždy so šalátom. Konzumácia cukrov na začiatku obeda alebo večere vedie k zvýšenej glykemickej variabilite (Shukla et al., 2019).
Druhou cestou, ako upraviť glykemickú variabilitu, môže byť fyzická aktivita. Pozitívny vplyv vhodne zvolenej fyzickej aktivity na glykemickú variabilitu a oxidatívny stres bol pozorovaný nielen u diabetikov, ale aj u nediabetikov. Boli študované rôzne režimy, ktoré zohľadňovali možnosti diabetikov a možnosti reálneho života (Zhou et al., 2020). Istým minimalistickým riešením by mohlo byť prerušovanie dlhodobého sedenia každých 15 minút chôdzou ľahkej intenzity v trvaní 3 minút, ktoré potvrdilo pozitívny účinok na glykémiu nalačno a nočnú variabilitu glykémie. Autori zvlášť zdôraznili, že ide o relatívne jednoduchú intervenciu (Paing et al., 2019).
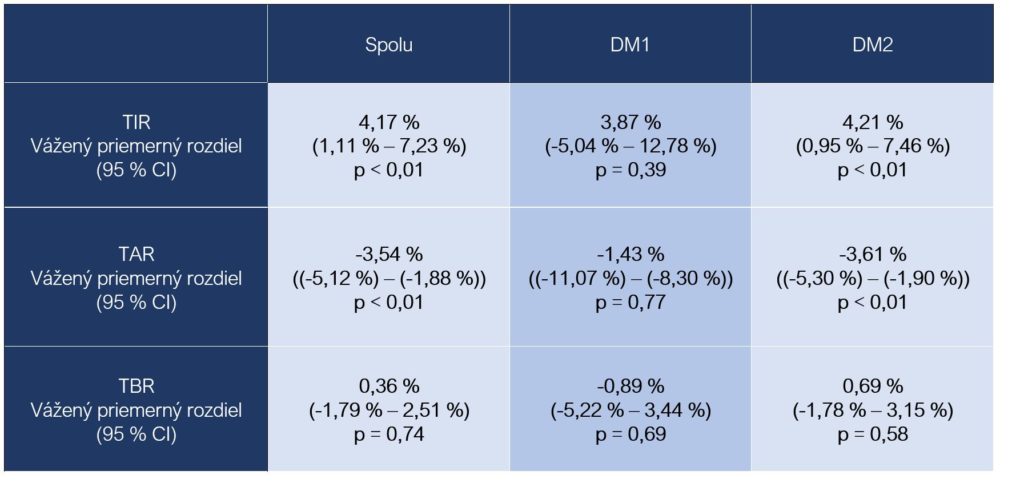
Metaanalýza 13 klinických štúdií (654 osôb s DM 1 alebo DM 2) hodnotila možnosti ovplyvnenia hodnôt v TIR pásme fyzickou aktivitou. Vo všetkých prípadoch išlo o randomizované klinické štúdie, kde bola aspoň v jednom ramene ako intervencia zvolená fyzická aktivita a zároveň existovalo kontrolné rameno bez fyzickej aktivity ako intervencie. Štatisticky významný pozitívny vplyv fyzickej aktivity na predĺženie časového intervalu stráveného v TIR pásme a skrátenie doby zotrvania v TAR pásme sa potvrdil len u osôb s DM 2 (Zhu et al., 2021):
Vážený priemerný rozdiel medzi hodnotami času stráveného v príslušnom meranom pásme medzi osobami zaradenými do ramena s intervenciou fyzická aktivita a osobami v kontrolnom ramene bez fyzickej aktivity ako intervencie.
Tretiu cestu ponúka moderná farmakologická liečba diabetu. Jednou z možností je použitie inzulínových analógov či už prandiálnych alebo dlhodobo pôsobiacich (zvlášť 2. generácie), o ktorých vieme, že okrem iného majú zníženú intraindividuálnu variabilitu v porovnaní s „klasickými“ inzulínmi (Mathieu et al., 2017). Ako sľubné sa tiež ukazuje využitie „umelého pankreasu“, ktorý konštrukčne vychádza z kontinuálneho monitorovania glykémie v spojení s automatickým dávkovaním inzulínu v prípade diabetu 1. typu, alebo inej farmakologickej liečby, ktorá znižuje glykemickú variabilitu v prípade diabetu 2. typu (Kovatchev, 2019; Ceriello et al., 2022).
Potenciál znižovať glykemickú variabilitu bol popísaný na základe klinických štúdií okrem analógov inzulínu aj u GLP-1 receptorových agonistov, SGLT2 inhibítorov a DPP-4 inhibítorov (Ceriello et al., 2019; Kovatchev, 2019). Vhodnou voľbou je napríklad použitie fixnej kombinácie GLP-1 receptorového agonistu lixisenatidu a dlho účinkujúceho inzulínového analógu glargín 100 U/ml (iGlarLixi). Simultánne podávanie obidvoch zložiek malo po 30 týždňoch väčší vplyv na úpravu glykemickej variability ako ich individuálne podávanie, navyše bez zvýšeného rizika hypoglykémie (Kovatchev et al., 2017; Umpierrez & Kovatchev, 2018; Aronson et al., 2019). Zaujímavé je, že v prípade fixnej kombinácie GLP-1 receptorového agonistu liraglutidu a dlho účinkujúceho inzulínového analógu degluteku 100 U/ml (iDegLira) nebolo pozorované zníženie glykemickej variability po 52 týždňoch liečby oproti individuálnemu podávaniu obidvoch komponentov (Vilsbøll et al., 2015; Umpierrez & Kovatchev, 2018). Možným vysvetlením je, že krátkodobo účinkujúci lixisenatid spomaľuje vyprázdňovanie žalúdka, čo má väčší účinok na postprandiálnu glykémiu v porovnaní s dlho účinkujúcim liraglutidom (Umpierrez & Kovatchev, 2018).
Z doterajších poznatkov je možné vyvodiť záver, že udržanie hodnôt glykemickej variability v rozmedzí hodnôt glykémie 3,9 – 10,0 mmol/l môže predstavovať účinnú cestu v prevencii mikro a makrovaskulárnych komplikácií u osôb s diabetom 2. typu.
Literatúra
- Aronson, R. et al. (2019): Diabetes Obes. Metab., 21, 726–731
- Battelino, T. et al. (2019): Diabetes Care, 42, 1593–1603
- Beck, R.W. et al. (2017): Diabetes Care, 40, 994–999
- Ceriello, A. et al. (2019): Lancet Diabetes Endocrinol., 7, 221-230
- Ceriello, A. et al. (2022): Lancet Diabetes Endocrinol., 10, 75-84
- Dovc, K., Battelino, T. (2021): Clin. Pediat. Endocrinol., 30, 1-10
- Gu, J. et al. (2018): Hellenic Soc. Cardiol., 59, 91-97
- Chehregosha, H. et al. (2019): Diabetes Ther., 10, 853–863
- Kovatchev, B. et al. (2017): Diabetes, 66(Suppl1), 2391-PUB
- Kovatchev, B. (2019): J. Diabet. Sci. Technol., 13, 627–635
- Lu, J. et al. (2021): Diabetes Care, 44, 549–555
- Mathieu, C. et al. (2017): Nature Rev. Endocrinol., 13, 385-399
- Monnier, L. et al. (2012): Diabetes Res. Clin. Pract., 95, 303-311
- Paing, A.C. et al. (2019): Diabet. Med., 36, 376-382
- Quang, L.M. (2019): Int. J. Diabetes. Clin. Res., 6, 1103
- Raj, R. et al. (2022): BMJ Open Diab. Res. Care, 10, e002573
- Sheng, X. et al. (2021): Int. J. Endocrinol., 2020, 8879085
- Shukla, A.P. et al. (2019): Diabetes Obes. Metab., 21, 377–381
- Singleton, M.J. et al. (2020): Diabetes, 69, 2186–2193
- Umpierrez, G.E., Kovatchev, B.P. (2018): Am. J.Med.Sci., 356, 518−527
- Vilsbøll, T., Philis-Tsimikas, A., Kilpatrick, E.S. (2015): Diabetologia, 58, S832
- Zhu, X. et al. (2021): Front. Endocrinol., 12, 767152



